EL CARBONO EN
LOS ALIMENTOS
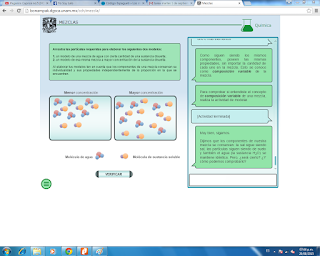
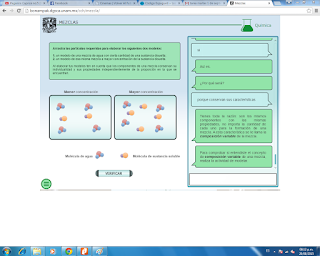
El carbono es un elemento único en la naturaleza ya que tienen la
cualidad de formar un numero muy grande de compuestos, característica que no
presentan el resto de elementos que existen en nuestro entorno.
Una característica importante del carbono es la extensa variedad
de compuestos que forma cuando se combina con H,O, N y otros elementos que son
la base principal de la composición de todos los seres vivos, animales y
vegetales, razón por la que se conoce como compuesto orgánico, una fuente de
obtención de compuestos orgánicos es el petroleo.
En la tabla periódica el carbono es el primer elemento de la
familia IVA de los elementos representativos y es un no metal se une
químicamente con otros elementos para formar compuestos inorgánicos como
carburos, óxidos y sales pero también forma una inmensa gama de compuestos
orgánicos.
Hay dos modelos que se complementan para explicar la estructura
atómica del carbono como el modelo de borh y lewis.
METANO:
Compuesto mas pequeño de los millones de compuestos que llegan a
formarse cuando se combinan átomos de carbono y hidrógeno.
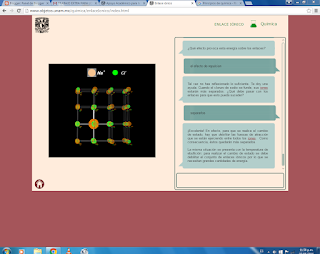
Enlaces que forma el carbono:
En esta figura muestra los enlaces
covalentes que se pueden formar entre los átomos de C mediante la comparticion
de electrones, aunque también muestran electrones sin pareja que pueden
establecer otros enlaces.
Cada enlace covalente se forma con un par
de electrones uno de cada átomo se une.
FULLERENOS: Tienen una estructura similar
al grafito pero el empaqueta miento hexagonal se combina con pentágonos (y en
ciertos casos heptágonos) los planos permite la aparición de estructura de
forma esférica, elipsoidal, o cilíndrica. Esta constituida por 60 átomos
de carbono su estructura es tridimensional y geometría similar a un balón
de fútbol.
NANOTUBOS: Son laminas de grafitos
enrolladas en forma de tubos, los nanotubos pueden ser abiertos o cerrados en
cuyo caso la estructura que cierra e nanotubo es similar a la mitad del
fullereno.
HIDROCARBUROS:
Los átomos de carbono se enlazan
químicamente entre si formando largas cadenas lineales o ramificadas. Los
átomos de carbono al combinarse químicamente ya sea entre si o con átomos de
otros elementos siempre van a formar 4 enlaces generalmente covalentes pueden
ser simples o dobles o triples.
ALIFATICOS: Son hidrocarburos de cadena
abierta o cerrada y se clasifican en instaurados dependiendo la cantidad de
átomos de hidrógeno y esta determinado por las uniones de carbono-carbono,
simples, dobles, triples llamados alcanos, alquenos o alquinos.
AROMATICOS: Son hidrocarburos cíclicos que contienen la estructura
básica del benceno.
HC SATURADOS: Son aquellos compuestos que tienen el máximo de
átomos de hidrógeno en su estructura molecular es decir es tan saturados de
hidrógeno estos presentan enlaces sencillos son también llamados alcanos y
parafinas.
HC INSATURADOS: Aquellos que tienen enlaces dobles o triples entre
los átomos de carbono que los forman. la cantidad de átomos de hidrógeno que
tienen los hidrocarburos instaurados es siempre menor a la de los saturados.
se dividen en:
*ALCANOS:- Enlaces covalentes simples
-Cadena abierta o cerrada
-lineales o ramificadas.
*ALQUENOS:-Enlaces dobles
-Clefinas
*ALQUINOS:-Enlace triple.
-Acetilinicos
#Hidrocarburos lineales: Esta constituido por una sola cadena de
átomos de carbono.
#Hidrocarburos Ramificados: La cadena de mayor numero de átomos de
carburo es considerada la cadena principal y las cadenas adicionales se
consideran ramificaciones.
FORMAS DE NOMENCATURA;
Se dividen en desarrollada, semi desarrollada, esqueleto, de
esferas y palos, condensada.
+Desarrollada: Se representan todo los átomos de carbono e
hidrógeno, Así como sus enlaces su estructura plana.
+Semidesarrollada: Se agrupan los hidrógenos al átomo de carbono
con el que se encuentran enlazados.
+De esqueleto: Consiste en trazar lineas zig-zag donde los
vértices y los extremos representan átomos de carbono unidos mediante lineas
sencillas dobles o triples los H no se representan.
+Esferas y palos: Son esferas compactadas y se unen mostrando el
acomodamiento espacial mas probables de los átomos de carbono de H.
+Condensada: En esta se agrupan todos los átomos de C y H.
NOMENCLATURA DE HIDROBARBUROS:
El numero de átomos de carbono que contienen las moléculas de los
hidrocarburos esta relacionado con su nombre se deben utilizar las raíces
griegas para indicar el numero de átomos que forman cadena o ramificación.
1-Se cuenta el numero de carbonos y se elige la raíz griega.
2.-Se identifica el tipo de enlaces que hay sencillo, doble o
triple para dar la terminación del nombre.
3-Si hay enlace doble o triple se encuentran los átomos de carbono
asignándole la menor posición de el enlace múltiple.
4-Se nombra el HC empezando por la posición del enlace doble o
triple y posteriormente se escribe la cadena principal.
ISOMERIA
El carbono al unirse a otros átomos de carbono produce una gran
variedad de compuestos. a partir de 4 átomos de carbono podemos encontrar 2 o
mas compuestos con la misma cantidad de átomos, en otras palabras tienen la
misma formula molecular o condensada, sin embargo, la distribución atómica de
estos es diferente, es decir estructuras no son iguales.
Dingrando, L. et al. (2002). Química,
Materia y Cambio. Colombia: McGraw- Hill.
García, J. y Ortega, F. (2004). Periodicidad Química. México:
Trillas.
Espriella, A. (2011). Química Orgánica Básica. Un acercamiento a la
estructura en el nivel nanoscópico para explicar lo macroscópico. México:
Universidad Autónoma de México, UAM.
Lewis, M. y Waller, G. (1995). Química Razonada. México: Trillas.
Morrison, R. y Boyd, R. (1998). Química orgánica. México:
Ed. Addison Wesley Longman.
Textos científicos (s/f). Modelo de
Repulsión de los Pares de Electrones de la Capa de Valencia. Recuperado
de http://www.textoscientificos.com/quimica/inorganica/vserp (abril,
2012).